Если это не аквариумный форум, то сюда тоже, если можно. Если форум, то мне в личку тоже, пожалуйста- разберемся.Andrey (nsk) будет у Вас в ЛС
-
Ю.В.

Концепция водорослевых обрастаний на растениях - стр. 10
-
serj973

Тут, собственно, невчем сходится - оно так и есть, для всех, не только для растений.Andrey (nsk) мы сошлись во мнении что избыток кислорода(более 8 мг/л) не есть хорошо для травы :mi_ga_et:
Вполне вероятный, во многих ситуациях случай.Andrey (nsk) Ну да) и рыба плавает у поверхности, от недостатка кислорода.
Интересно, что тогда показывает тест на окисляемость?Andrey (nsk) Да ну? рыбы постоянно выделяют отходы жизнедеятельности, так что это не совсем верное утверждение!
И в какое время он проводится?
Избыток кислорода в первую очередь убьет рыб, и лишь потом возьмется за растения - но, все это пустой звук - ни разу не видел его избытка - он очень легко поступает в воду, и так-же легко покидает.
-
Andrey (nsk)

Величина окисляемости характеризует количество органических и минеральных веществ, окисляемых при определенных условиях,serj973 Интересно, что тогда показывает тест на окисляемость?И в какое время он проводится?Избыток кислорода в первую очередь убьет рыб, и лишь потом возьмется за растения - но, все это пустой звук - ни разу не видел его избытка - он очень легко поступает в воду, и так-же легко покидает.
величина окисляемости определяется расходом окислителя или эквивалентного количества кислорода.
Не очень мне понятен вопрос о времени) Отвечу так: после кормления, внесения некоторых удобрений, величина окисляемости
несколько вырастит(по сравнению с показателем до внесения) как и расход кислорода.
Величина кислорода в 8мг/л(какой можно достичь при активном фотосинтезе большого кол-ва растений), не убьют рыбу, (я не говорю о каких-либо запредельных концентрациях), но потребует от аквариумиста ежедневного внесения в воду более устойчивых к окислению(хелатированных) микроэлементов, если говорить о железе то, в кол-ве которое не вызовет появление колоний железобактерий(каторым для окисления нужно много кислорода) и в то же время будет удовлетворять потребность растений, либо изначальное использование питательного субстрата с возможностью протекания в нем восстановительных процессов, чтоб компенсировать потери элементов в воде.
-
serj973

И что из этого следует?Andrey (nsk) Величина окисляемости характеризует количество органических и минеральных веществ, окисляемых при определенных условиях,
величина окисляемости определяется расходом окислителя или эквивалентного количества кислорода.
Вы методичку проведения теста на окисляемость читали?Andrey (nsk) Не очень мне понятен вопрос о времени) Отвечу так: после кормления, внесения некоторых удобрений, величина окисляемости
несколько вырастит(по сравнению с показателем до внесения) как и расход кислорода.
Эта часть вполне логична - но, повторюсь - причина далеко не в низкой окисляемости - тут у вас понятие неправильное - это не столько химия, сколько биология.Andrey (nsk) Величина кислорода в 8мг/л(какой можно достичь при активном фотосинтезе большого кол-ва растений), не убьют рыбу, (я не говорю о каких-либо запредельных концентрациях), но потребует от аквариумиста ежедневного внесения в воду более устойчивых к окислению(хелатированных) микроэлементов, если говорить о железе то, в кол-ве которое не вызовет появление колоний железобактерий(каторым для окисления нужно много кислорода) и в то же время будет удовлетворять потребность растений, либо изначальное использование питательного субстрата с возможностью протекания в нем восстановительных процессов, чтоб компенсировать потери элементов в воде.
-
Andrey (nsk)

Сергей, по вашему я зря косвенно связываю кол-во кислорода с окисляемостью?
В общем-то в первую очередь я связываю этот тест с rH...
"Многие химические реакции, происходящие B природе, называются окислением или восстановлением. Например, пламя - это пример окислительной реакции, во время которой горящее вещество соединяется с кислородом, иными словами, окисляется.
Восстановление - это противоположная реакция. Ее примером может быть восстановление железа из ржавчины под воздействием специального состава. В этом случае ржавчина, являющаяся соединением атомов железа и кислорода, превращается в чистое железо, потому что водород забирает из молекулы окисла кислород и образует с ним молекулу воды. Кислород - это не единственный окислитель в природе, но в случае, если мы говорим о живой природе, он является наиболее широко распространенным. Его могут заменить хлор, бром и другие галогены. Точно так же восстановление может происходить при участии не только чистого водорода, но и метана или аммиака. В целом, в химии реакциями окисления называют, как правило, те, в которых вещество, соединяясь с другим, отдает свои электроны. Соответственно, в реакциях восстановления электроны приобретаются от другого компонента в молекуле.
Реакции окисления и восстановления протекают в противоположных направлениях, которые могут изменяться. В воде присутствуют окислители (в основном кислород, реже хлор), а также восстановители (метан и аммиак). В зависимости от того, какие вещества преобладают, жидкость приобретает более или менее выраженную способность окислять либо восстанавливать. Чтобы измерять эту способность, применяют такой показатель, как окислительно-восстановительный потенциал. Сокращенно его обозначают как rН. На одном конце шкалы rН находится атмосфера из чистого водорода, на другом - из чистого кислорода. Величина окислительно-восстановительного потенциала в водородной среде равна rН 0, в чистом кислороде - rН 42. Нередко rН называют редокс потенциалом - это сокращение от латинских слов reductio и oxidado, то есть "восстановление" и "окисление".
Рыбы и растения способны жить в диапазоне rН 25-35. Некоторые виды чувствуют себя лучше в более узких диапазонах окислительно-восстановительного потенциала:
rH 28,3-28,5 - оптимален для крип-токорин, лимнофил, других болотных растений;
rН 29-30 - для большинства водных растений, в частности для апоногетонов и эхинодорусов;
rН 30,2-30,6 - бурный рост валлиснерии, роталы, цветение эхинодорусов и апоногетонов; криптокорины в такой среде сбрасывают листья;
rН 30,7-31 - хорошо развивается гетерантера, кабомба, синнема; апоногетоны сбрасывают листья, у криптокорин отмирают корни, эхинодорусы прекращают рост;
rН31-32 - бурно, развиваются зеленые водоросли.
Окислительно-восстановительный потенциал и активная реакция воды связаны между собой. Кроме того, rН измеряется рН-метром, и нередко это значение выражается не в приведенных выше единицах, а в милливольтах напряжения между электродами прибора. Чтобы определить такую величину, следует воспользоваться формулой:
rН = Е/0,029+2*РН,
где Е - напряжение между электродами рН-метра, В.
Величину окислительно-восстановительного потенциала в аквариуме следует контролировать потому, что именно этот показатель позволяет четко понять, может ли находиться тот или иной микроэлемент в форме, доступной для растений. Если величина rН высокая, то большинство веществ находится в виде окислов, поэтому растения не могут их поглотить. Так как в аквариумной воде основным окислителем является кислород, свежая водопроводная вода обладает высоким окислительно-восстановительным потенциалом, повышающимся при аэрировании.
В аквариумной практике всегда старались увеличить концентрацию О2 в воде, необходимую для дыхания рыб и растений. Эта задача была актуальной, когда не существовало эффективных аэраторов и насосов. Ее решение позволяло содержать больше рыбок в маленьком водоеме, а растения в то время в основном воспринимались лишь как источник кислорода. Аквариумисты-рыбоводы и далее могут придерживаться таких взглядов, поскольку чем больше в воде кислорода, тем крепче здоровье растений и ярче их краски. А вот растениеводы в последние десятилетия заподозрили, что избыток этого газа создает немало проблем. Если концентрация кислорода в аквариумной воде 2-5 мг/л, то в таком водоеме и рыбы себя чувствуют хорошо, и растения растут неплохо (конечно, если выполнены остальные необходимые для их роста условия). Но стоит повысить концентрацию до 8-10 мг/л, как растение прекратит рост. Причина - в изменении rН воды, ее возросший окислительный потенциал переводит жизненно важные микроэлементы в состояние, непригодное для поглощения растениями. При концентрациях кислорода выше 5 мг/л почти все микроэлементы становятся малодоступными для растений.
Излишне высокий окислительный потенциал препятствует фотосинтезу. Внутри хлоропласта величина должна сохраняться на низком уровне - rН 0,83. Если же вокруг листа находится вода с высоким окислительно-восстановительным потенциалом, то растение защищает себя и справляется с разницей потенциалов, которая для свежей воды составляет ощутимую величину - почти 1 В! На это расходуется много энергии, порой больше, чем запасается при фотосинтезе. Эксперименты показали, что проблемы с такими сложными в культуре растениями, как барклая, маяка и красная кабомба, заключаются как раз в том, что они не могут защитить свои фотосинтезирующие центры от воды с высоким окислительным потенциалом. Эти растения могут пострадать как в результате массивной подмены свежей водой, так и при резком усилении освещения. Подобные перемены должны производиться постепенно."
И. Шереметьев
В общем-то в первую очередь я связываю этот тест с rH...
"Многие химические реакции, происходящие B природе, называются окислением или восстановлением. Например, пламя - это пример окислительной реакции, во время которой горящее вещество соединяется с кислородом, иными словами, окисляется.
Восстановление - это противоположная реакция. Ее примером может быть восстановление железа из ржавчины под воздействием специального состава. В этом случае ржавчина, являющаяся соединением атомов железа и кислорода, превращается в чистое железо, потому что водород забирает из молекулы окисла кислород и образует с ним молекулу воды. Кислород - это не единственный окислитель в природе, но в случае, если мы говорим о живой природе, он является наиболее широко распространенным. Его могут заменить хлор, бром и другие галогены. Точно так же восстановление может происходить при участии не только чистого водорода, но и метана или аммиака. В целом, в химии реакциями окисления называют, как правило, те, в которых вещество, соединяясь с другим, отдает свои электроны. Соответственно, в реакциях восстановления электроны приобретаются от другого компонента в молекуле.
Реакции окисления и восстановления протекают в противоположных направлениях, которые могут изменяться. В воде присутствуют окислители (в основном кислород, реже хлор), а также восстановители (метан и аммиак). В зависимости от того, какие вещества преобладают, жидкость приобретает более или менее выраженную способность окислять либо восстанавливать. Чтобы измерять эту способность, применяют такой показатель, как окислительно-восстановительный потенциал. Сокращенно его обозначают как rН. На одном конце шкалы rН находится атмосфера из чистого водорода, на другом - из чистого кислорода. Величина окислительно-восстановительного потенциала в водородной среде равна rН 0, в чистом кислороде - rН 42. Нередко rН называют редокс потенциалом - это сокращение от латинских слов reductio и oxidado, то есть "восстановление" и "окисление".
Рыбы и растения способны жить в диапазоне rН 25-35. Некоторые виды чувствуют себя лучше в более узких диапазонах окислительно-восстановительного потенциала:
rH 28,3-28,5 - оптимален для крип-токорин, лимнофил, других болотных растений;
rН 29-30 - для большинства водных растений, в частности для апоногетонов и эхинодорусов;
rН 30,2-30,6 - бурный рост валлиснерии, роталы, цветение эхинодорусов и апоногетонов; криптокорины в такой среде сбрасывают листья;
rН 30,7-31 - хорошо развивается гетерантера, кабомба, синнема; апоногетоны сбрасывают листья, у криптокорин отмирают корни, эхинодорусы прекращают рост;
rН31-32 - бурно, развиваются зеленые водоросли.
Окислительно-восстановительный потенциал и активная реакция воды связаны между собой. Кроме того, rН измеряется рН-метром, и нередко это значение выражается не в приведенных выше единицах, а в милливольтах напряжения между электродами прибора. Чтобы определить такую величину, следует воспользоваться формулой:
rН = Е/0,029+2*РН,
где Е - напряжение между электродами рН-метра, В.
Величину окислительно-восстановительного потенциала в аквариуме следует контролировать потому, что именно этот показатель позволяет четко понять, может ли находиться тот или иной микроэлемент в форме, доступной для растений. Если величина rН высокая, то большинство веществ находится в виде окислов, поэтому растения не могут их поглотить. Так как в аквариумной воде основным окислителем является кислород, свежая водопроводная вода обладает высоким окислительно-восстановительным потенциалом, повышающимся при аэрировании.
В аквариумной практике всегда старались увеличить концентрацию О2 в воде, необходимую для дыхания рыб и растений. Эта задача была актуальной, когда не существовало эффективных аэраторов и насосов. Ее решение позволяло содержать больше рыбок в маленьком водоеме, а растения в то время в основном воспринимались лишь как источник кислорода. Аквариумисты-рыбоводы и далее могут придерживаться таких взглядов, поскольку чем больше в воде кислорода, тем крепче здоровье растений и ярче их краски. А вот растениеводы в последние десятилетия заподозрили, что избыток этого газа создает немало проблем. Если концентрация кислорода в аквариумной воде 2-5 мг/л, то в таком водоеме и рыбы себя чувствуют хорошо, и растения растут неплохо (конечно, если выполнены остальные необходимые для их роста условия). Но стоит повысить концентрацию до 8-10 мг/л, как растение прекратит рост. Причина - в изменении rН воды, ее возросший окислительный потенциал переводит жизненно важные микроэлементы в состояние, непригодное для поглощения растениями. При концентрациях кислорода выше 5 мг/л почти все микроэлементы становятся малодоступными для растений.
Излишне высокий окислительный потенциал препятствует фотосинтезу. Внутри хлоропласта величина должна сохраняться на низком уровне - rН 0,83. Если же вокруг листа находится вода с высоким окислительно-восстановительным потенциалом, то растение защищает себя и справляется с разницей потенциалов, которая для свежей воды составляет ощутимую величину - почти 1 В! На это расходуется много энергии, порой больше, чем запасается при фотосинтезе. Эксперименты показали, что проблемы с такими сложными в культуре растениями, как барклая, маяка и красная кабомба, заключаются как раз в том, что они не могут защитить свои фотосинтезирующие центры от воды с высоким окислительным потенциалом. Эти растения могут пострадать как в результате массивной подмены свежей водой, так и при резком усилении освещения. Подобные перемены должны производиться постепенно."
И. Шереметьев
-
serj973

Ну, во первых, окисляемость и окислительно-восстановительный потенциал - разные вещи.
При тесте на окисляемость мы определяем, в первую очередь, наличие не разложенной органики в воде - именно это нас и интересует - мы не мерим количество кислорода - у нас отличный индикатор есть - рыбки. И этот тест показывает биологическую активность воды. А ваша цитата - тоже не последняя инстанция - по ней выходит, что растения самоубийцы - а это не так. Да и цифра концентрации кислорода без привязки к температуре - пустой звук - поэтому, найдя одну ошибку, что можно подумать о статье?
Пересмотрел - не я один в этой теме про это пишу -
При тесте на окисляемость мы определяем, в первую очередь, наличие не разложенной органики в воде - именно это нас и интересует - мы не мерим количество кислорода - у нас отличный индикатор есть - рыбки. И этот тест показывает биологическую активность воды. А ваша цитата - тоже не последняя инстанция - по ней выходит, что растения самоубийцы - а это не так. Да и цифра концентрации кислорода без привязки к температуре - пустой звук - поэтому, найдя одну ошибку, что можно подумать о статье?
Пересмотрел - не я один в этой теме про это пишу -
Селитра Низкая окисляемость говорит исключительно о том, что в воде содержится мало соединений, способных окисляться - не более того. О концентрации кислорода по этому тесту судить нельзя. А соединения эти могут быть и органическими, и неорганическими. Например, нитрит может окисляться до нитрата, принимая атом кислорода. И реакция на окисляемость это покажет. Но в воде может быть 200 мг/л нитрата, а тест этого не покажет. Также этот тест показывает наличие непредельных органических соединений, способных принимать кислород.
-
Andrey (nsk)

Думаю что эти понятия будут взаимасвязанны в условиях аквариума с постоянным поступлением вещества способного к окислению,serj973 Ну, во первых, окисляемость и окислительно-восстановительный потенциал - разные вещи.
и в условиях преобладаюшего в аквариуме окислителя-кислорода.
у разных рыб разная потребность в кислороде...serj973 не мерим количество кислорода - у нас отличный индикатор есть - рыбки.
что представляет собой "биологическая активность воды"?serj973 И этот тест показывает биологическую активность воды.
от куда такие выводы?serj973 А ваша цитата - тоже не последняя инстанция - по ней выходит, что растения самоубийцы - а это не так.
при какой температуре невозможно достичь уровня растворенного кислорода в 8-10 мг/л?serj973 Да и цифра концентрации кислорода без привязки к температуре - пустой звук - поэтому, найдя одну ошибку, что можно подумать о статье?
-
Селитра

1. Перманганатная окисляемость и концентрация кислорода - разные вещи, хоть и взаимосвязанные.
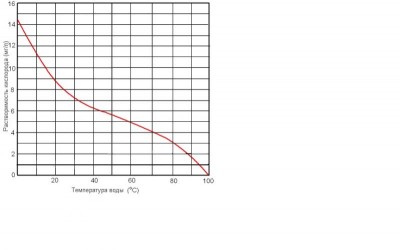
2. Не умею вставлять таблицы, но попробую дать хоть таким образом предельную растворимость кислорода в воде в зависимости от температуры
Температура, ° С 15 18 20 25 30
Растворимость О2,мг/л 10,1 9,5 9,1 8,3 7,5
Как видно, при 20 град. предельная растворимость 8,3 мг/л, при 25 - еще меньше. Все, что лишнее, будет просто улетучиваться.
2. Не умею вставлять таблицы, но попробую дать хоть таким образом предельную растворимость кислорода в воде в зависимости от температуры
Температура, ° С 15 18 20 25 30
Растворимость О2,мг/л 10,1 9,5 9,1 8,3 7,5
Как видно, при 20 град. предельная растворимость 8,3 мг/л, при 25 - еще меньше. Все, что лишнее, будет просто улетучиваться.
-
serj973

Да, только в противоположном, чем ваше понимание, смысле - чем выше окисляемость, тем большее потребление кислорода - тем меньшее его содержание при равных остальных.Andrey (nsk) Думаю что эти понятия будут взаимасвязанны в условиях аквариума с постоянным поступлением вещества способного к окислению,
и в условиях преобладаюшего в аквариуме окислителя-кислорода.
Не утрируйте.Andrey (nsk) у разных рыб разная потребность в кислороде.
Состав, плотность, дислокация микрофауны водоема.Andrey (nsk) что представляет собой "биологическая активность воды"?
Из головы, понятное дело. :-):Andrey (nsk) от куда такие выводы
Вот цитата из приведенного вами опуса
Это, мягко говоря, ошибочно - вот вам моя цепочка рассуждений:Andrey (nsk) Излишне высокий окислительный потенциал препятствует фотосинтезу. Внутри хлоропласта величина должна сохраняться на низком уровне - rН 0,83. Если же вокруг листа находится вода с высоким окислительно-восстановительным потенциалом, то растение защищает себя и справляется с разницей потенциалов, которая для свежей воды составляет ощутимую величину - почти 1 В! На это расходуется много энергии, порой больше, чем запасается при фотосинтезе. Эксперименты показали, что проблемы с такими сложными в культуре растениями, как барклая, маяка и красная кабомба, заключаются как раз в том, что они не могут защитить свои фотосинтезирующие центры от воды с высоким окислительным потенциалом.
При активном фотосинтезе растения выделяют кислород в количестве, многократно превышающим растворимость оного в воде, поэтому в период освещенности мы наблюдаем "пузыряние" растений. Из этого можно сделать вывод, что в период фотосинтеза концентрация кислорода вокруг растения, внутри листа, находится в предельном значении. Если бы ситуация обстояла так, как в цитате выше, процесс фотосинтеза не шел бы вообще - не хватало-бы энергии.
Тире между цифрами не канает - что живет при 8, замерзнет при 10.Andrey (nsk) при какой температуре невозможно достичь уровня растворенного кислорода в 8-10 мг/л?
Вот таблица.
-
Andrey (nsk)

я ж и не говорю что одно и тоже! И если "знаешь" свой аквариум можно сделать определенные выводы не только о кол-веСелитра 1. Перманганатная окисляемость и концентрация кислорода - разные вещи, хоть и взаимосвязанные.
окисляемых веществ, но и о кол-ве окисляющего вещества.